- شناسه کاربر
- 154
- تاریخ ثبتنام
- 2020-11-14
- آخرین بازدید
- موضوعات
- 726
- نوشتهها
- 1,404
- راهحلها
- 18
- پسندها
- 4,356
- امتیازها
- 407
- سن
- 19
- محل سکونت
- دنیای موسیقی:)
فرض کنید که میخواهید دنیایی همانند آنچه در آن زندگی میکنید، از نو بسازید. از کجا این کار را شروع میکنید؟ احتمالاً بگویید که نیاز به انسانها، خاک، آب، درختان و … دارید. حال اگر به شما فقط چند ده اتم میدادند چه میکردید؟! با اتمها نیز شما میتوانید تمامی این عالم را از نو بسازید.
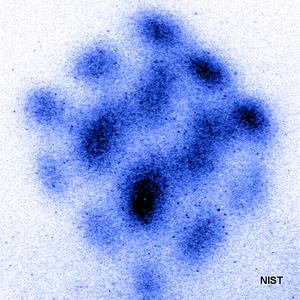
تصویر (۱): نمایی از اتمهای استرانسیوم (Strontium) تحریک شده توسط پالس لیزری در یک ساختار مکعبی که توسط میکروسکوپ الکترونی در موسسه تحقیقاتی NIST تهیه شده است.
میتوان گفت که یک اتم، کمترین و کوچکترین مقدار یک عنصر شیمیایی است. به طور مثال، کمترین مقدار طلایی که میتوانید داشته باشید ۱ اتم است. ۱ اتم اندازه بسیار کوچکی دارد که حتی با میکروسکوپهای الکترونی قوی نیز دیدن آنها مشکل است. ابعاد یک اتم حتی از مرتبه نانو نیز کوچکتر بوده و در محدوده آنگستروم است. در مدل اتمی بور، شعاع یک اتم هیدروژن به مقدار 0.5 آنگستروم نتیجه شد. اتمهای سنگینترین عناصر نیز تنها کمی از این مقدار بیشتر هستند. لازم به ذکر است که هر ۱ آنگستروم (Angstrom) برابر با 10−1010−10 است.
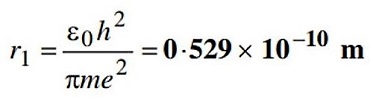
شعاع اتم هیدروژن که به شعاع بوهر معروف است. نیلز بوهر (Niels Bohr) در مدل اتمی خود که رویکردی شبه-کوانتومی داشت، به بررسی اتم هیدروژن پرداخت (1A=10−10m1A=10−10m).
شاید بگویید که اتم نیز قابل تقسیم است. بله این مطلب درست است، اما دقت شود که در اینجا کوچکترین مقدار یک عنصر همان اتم است. میدانیم که یک اتم از ذرات کوچکتری که به ذرات زیراتمی (الکترون، پروتون و نوترون) موسوم هستند، تشکیل شدهاند. اگر شما اتم را نیز به قطعات کوچکتری تقسیم کنید و یک پروتون از آن را جدا کنید (یا حتی بتوانید اضافه کنید)، اتم حاصل شده، دیگر اتمی از عنصر قبلی نیست. بلکه تبدیل به اتم دیگری میشود. جهت آشنایی بیشتر با عنصر، به مقاله «عنصر چیست؟ — به زبان ساده» مراجعه فرمایید.
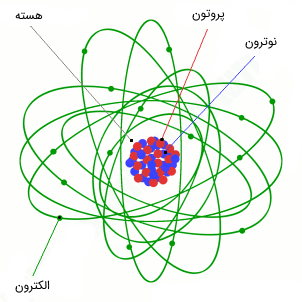 شکل (۲): شماتیکی از یک اتم که از هسته (شامل پروتون و نوترون) و الکترونهایی که به دور آن قرار گرفتهاند.
شکل (۲): شماتیکی از یک اتم که از هسته (شامل پروتون و نوترون) و الکترونهایی که به دور آن قرار گرفتهاند.
از نقطه نظر مکانیک کوانتومی، تعیین دقیق مکان یک الکترون ممکن نیست. فرض کنید که الکترونها آنقدر سریع تغییر مکان میدهند که امکان مشاهده آنها در مکانی خاص وجود ندارد. البته در برخی مکانها در لایههای مختلف، احتمال حضور الکترونها بیشتر است. به همین دلیل برخی کتابها الکترونها را به صورت هاشورهایی نمایش میدهند. به این مکانها، که احتمال حضور الکترون در آنها نسبت به جاهای دیگر زیاد است، اوربیتال گفته میشود. اوربیتالها بسته به موقیعت الکترونها که با اعداد کوانتومی مشخص میشود، شکلهای متفاونی دارند.
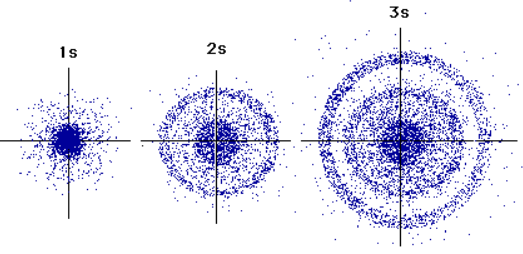 شکل (۳): شماتیکی از اوربیتالهای S که شکلی کروی دارند.
شکل (۳): شماتیکی از اوربیتالهای S که شکلی کروی دارند.
در بخش قبل گفتیم که با جداکردن یک پروتون از هسته اتم، آن اتم تبدیل به اتمی دیگر با خواص متفاوت میشود. آنچه اتمها را از یکدیگر متمایز میکند، تعداد پروتون و نوترونهای هسته و الکترونهای یک اتم است. در واقع جنس الکترون، پروتون و نوترونهای یک اتم طلا با اتم آهن یا هر اتم دیگری یکسان است. تفاوتهای ایجاد شده در خصوصیات اتمهای مختلف تنها در تعداد این ذرات است.
اجازه دهید دوباره به فرضی که در مقدمه متن عنوان شد باز گردیم. با توجه به مطالب گفته شده، شما میتوانید با تغییر در تعداد ذرات زیر اتمی، یک اتم را به اتمِ دیگری تبدیل کنید. کار را میتوانیم از سادهترین و کوچکترین (در واقع ابتداییترین) اتم، یعنی اتمِ هیدروژن (Hydrogen Atom) شروع کنیم. اتمِ هیدروژن تنها ۱ پروتون و ۱ الکترون دارد (اتمِ هیدروژن نوترون ندارد). با اضافه کردن ۱ پروتون، ۱ الکترون و ۲ نوترون به اتمِ هیدروژن میتوانید اتمِ گازی هلیوم (Helium Atom) را بسازید. حال دوباره با اضافه کردن ۱ پروتون، ۱ الکترون و ۲ نوترون به اتمِ هلیوم، میتوانید اتمِ فلزی لیتیوم (Lithium Atom) را بسازید. این روند را میتوانید تا تکمیل جدول تناوبی عناصر ادامه دهید (شکل 4).
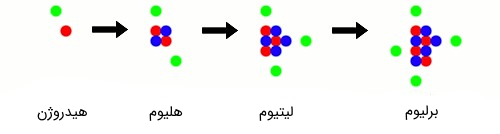 شکل (۴): ساخت اتمهای جدول تناوبی از اتمهای قبلی
شکل (۴): ساخت اتمهای جدول تناوبی از اتمهای قبلی
همانطور که مشاهده کردید، در یک اتمِ خنثی تعداد الکترونها و پروتونها برابر است. تعداد الکترونها در یک اتم میتواند تغییر کند، که در این صورت به اتم، یون میگویند. اگر تعداد الکترونها کمتر از حالت خنثی، یعنی کمتر از تعداد پروتونها باشد، اتم را یون مثبت و اگر تعداد الکترونها بیشتر از تعداد پروتونها باشد، اتم را یون منفی میگویند. باز هم یادآور میشویم که تغییر در تعداد ذرات هسته اتم، به منزله تغییر ماهیت اتم است.
تعداد نوترونهای یک اتم میتواند متفاوت با تعداد پروتونها باشد، اما در اغلب حالتها تعداد پروتونها و نوترونها متفاوت است. به تعداد پروتونهای هسته یک اتم، عدد اتمی میگویند. همچنین به مجموع تعداد پروتونها و نوترونها، عدد جرمی گفته میشود. از آنجایی که جرم یک پروتون یا یک نوترون تقریباً 2000 برابر جرم یک الکترون است، جرم یک اتم را با تقریب خوبی میتوان جرم هسته آن در نظر گرفت. به جدول زیر دقت کنید.
عدد اتمی، بیانگر نوع اتم است. چینش جدول تناوبی عناصر نیز بر اساس افزایش عدد اتمی است. عدد اتمی ۱ به معنی هیدروژن، عدد اتمی ۲ به معنی هلیوم، عدد اتمی ۳ به معنی لیتیوم و … است.
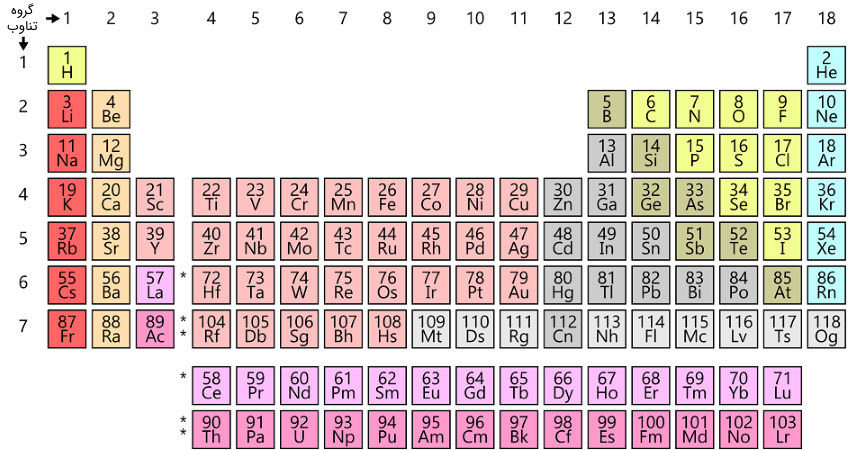 شکل (5): جدول تناوبی عناصر، عدد اتمی، بالای نماد شیمیایی هر عنصر نوشته شد است.
شکل (5): جدول تناوبی عناصر، عدد اتمی، بالای نماد شیمیایی هر عنصر نوشته شد است.
لازم به ذکر است که پروتونها و نوترونها نیز خود از ذرات کوچکتری موسوم به کوارک تشکیل شدهاند. در شاخهای از فیزیک نظری، موسوم به فیزیک ذرات بنیادی به بررسی ذرات تشکیل دهنده هسته اتمها در ریزترین مقیاس میپردازند. لازم به ذکر است که الکترون خود ذرهای بنیادی است و از ذرات دیگر تشکیل نشده است.
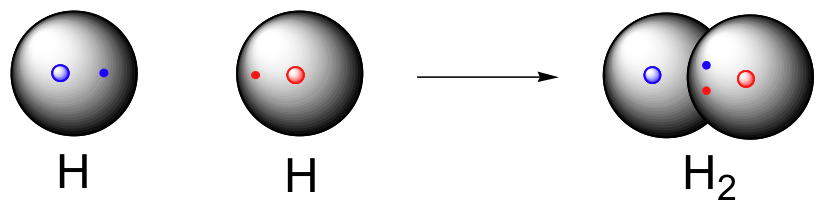 شکل (6): دو اتمِ هیدروژن با اشتراک گذاری الکترونهای خود مولکول هیدروژن (H2H2) را میسازند.
شکل (6): دو اتمِ هیدروژن با اشتراک گذاری الکترونهای خود مولکول هیدروژن (H2H2) را میسازند.
اکثر افراد در تعاریف مولکول و ترکیب دچار اشتباه میشوند. اگر دو عنصر شیمیایی مختلف به یکدیگر بپیوندند، اغلب میتوانند یک ماده جدید را تشکیل دهند. به طور مثال، پیوند بین دو اتم هیدروژن و یک اتم اکسیژن، مولکول واحد آب را درست میکنند. آب یک ترکیب است، چرا که از ترکیب دو عنصر شیمیایی متفاوت به دست آمده است. همچنین به دلیل اینکه از ترکیب چند اتم پدید آمده، به عنوان یک مولکول نیز شناخته میشود. در واقع، ترکیبات، عناصری هستند که به یکدیگر متصل شدهاند و ملکولها، اتمهایی هستند که به یکدیگر وصل شدهاند.
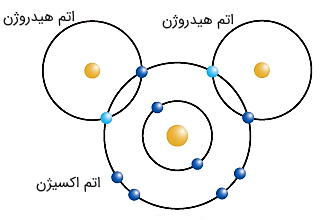 شکل (7): دو اتم هیدروژن و یک اتم اکسیژن از طریق پیوند کوالانسی، مولکول آب را تشکیل میدهند.
شکل (7): دو اتم هیدروژن و یک اتم اکسیژن از طریق پیوند کوالانسی، مولکول آب را تشکیل میدهند.
جهت تعریف عنصر نیز میتوانیم بگوییم که عنصر ماده خالصی است که نمیتوان آن را به دو یا چند ماده تفکیک کرد. در واقع خواص یک عنصر ثابت است و نمیتوان با تفکیک آن موادی با خواص متفاوت به دست آورد. در نتیجه، عنصر مادهای است که تمام واحدهای تشکیل دهنده آن، اتمهای یکسانی باشند که به مواد سادهتری تجزیه نشوند.
همه مولکولها، به اندازه مولکول آب ساده و کوچک نیستند. به طور مثال مولکولهای مادهای پلاستیکی، از صدها یا حتی هزاران اتم جداگانه که به صورت زنجیروار یا رشتهای طولانی، موسوم به پلیمر، به یکدیگر متصل هستند، ساخته شدهاند. به طور مثال، مولکولهای پلیاتیلن (Polyethylene) نمونه سادهای از این مورد هستند. این پلیمر، با تکرار واحدهای یکسانی موسوم به مونومر، ساخته شدهاند.
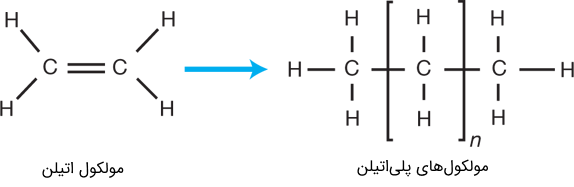 شکل (8): ساختار مولکولی پلیاتیلن
شکل (8): ساختار مولکولی پلیاتیلن
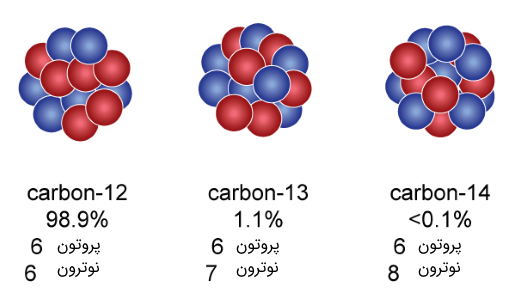 شکل (۹): ایروتوپهای مختلف اتم کربن. فراوانترین ایزوتوپ این اتم کربن-۱۲ با فراوانی 98.9% در طبیعت است.
شکل (۹): ایروتوپهای مختلف اتم کربن. فراوانترین ایزوتوپ این اتم کربن-۱۲ با فراوانی 98.9% در طبیعت است.
در مقدمه گفتیم که با تغییر دادن هسته اتمها میتوانیم اتمهای جدید را درست کنیم. پیشتر گفتیم که برای تولید هلیوم نیاز داریم تا ۱ پروتون، ۱ الکترون و ۲ نوترون به اتم هیدروژن اضافه کنیم. از آنجایی که اتم هیدروژن فاقد نوترون بوده، با ترکیب هستههای آن نمیتوان به اتم هلیم رسید. به نظر شما چگونه دو نوترون مورد نیاز را فراهم کنیم؟
برای تولید هلیوم از هیدروژن، به سراغ ایزوتوپهای اتم هیدروژن که حاوی نوترونها هستند میرویم .هیدروژن، دارای ۲ ایزوتوپ دیگر به نامهای دوتریوم (21D12D) و تریتیوم (21T12T) است که ساختار آنها در شکل زیر آمده است. پایدارترین این ایزوتوپها پروتیون (11H11H) با عدد جرمی ۱ است که غالباً آن را به همان نام هیدروژن میشناسیم. ایزوتوپ دوتریوم نیز به مقدار کمی در آب یافت میشود که به آب سنگین موسوم هستند. تریتیوم نیز در آزمایشگاه ساخته شده و پایداری خیلی کمتری دارد.
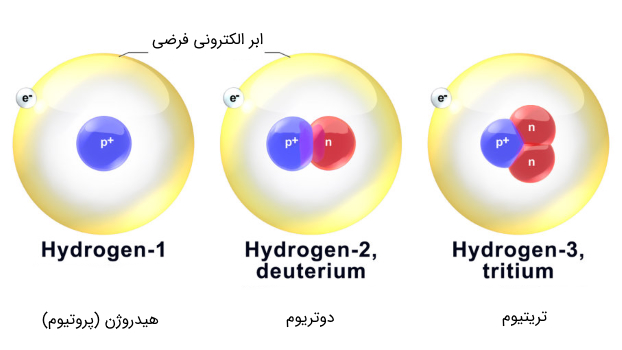 شکل (10): سه ایزوتوپ معروف اتم هیدروژن
شکل (10): سه ایزوتوپ معروف اتم هیدروژن
با استفاده از ایزوتوپ هیدروژن در راکتورهای همجوشی هستهای، میتوان به اتم هلیوم رسید. در راکتورهای همجوشی هستهای پلاسمایی از ایزوتوپهای هیدروژن با انرژی بسیار زیاد موجودند که طی فرآیندهایی کنترل شده در محیط راکتور، به یکدیگر برخورد کرده و هستههای آنها به اصطلاح به یکدیگر مطابق فرآیند زیر جوش میخورند. نوترون پرانرژی اضافی آزاد شده نیز از آنجا که خطرآفرین است، کنترل شده و جذب محیط میشود.
21D+31T→42He(3.5MeV)+n0(14.1MeV)12D+13T→24He(3.5MeV)+n0(14.1MeV)
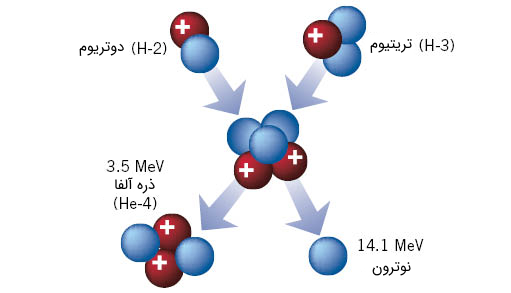 شکل (11): شماتیکی از فرآیند همجوشی هستهای اتمهای تریتیوم و دوتریوم برای تولید انرژی که در این حین ذره آلفا (یون دوبار مثبت هلیوم) تشکیل میشود.
شکل (11): شماتیکی از فرآیند همجوشی هستهای اتمهای تریتیوم و دوتریوم برای تولید انرژی که در این حین ذره آلفا (یون دوبار مثبت هلیوم) تشکیل میشود.
همچنین میتوان با همجوشی هستهای دو اتمِ دوتریوم (21D12D) و لیتویم (63Li36Li)، به دو اتمِ هلیوم رسید.
21D+63Li→2(42He)+22.4MeV12D+36Li→2(24He)+22.4MeV
از طریق فرآیندهای همجوشی هستهای میتوان به اتمهای دیگری نیز دست پیدا کرد، اما از آنجا که انرژی مورد نیاز برای اتمهای سنگینتر از هلیوم بسیار زیاد است، تا به امروز چنین کاری امکان انجام ندارد.
به عنوان مثالی دیگر از واپاشی اتمهای رادیواکتیو میتوان به اتم رادیوم (Ra) اشاره کرد که پس از واپاشی به ذره آلفا (24He2+42He2+) و اتم رادون (Rn) تبدیل میشود. اتم رادون از خانواده گازهای نجیب است که آن را غالباً از واپاشی اتم رادیوم به دست میآورند. ذره آلفا نیز اتم هلیوم دوبار مثبت یا یون هلیوم است که هیچ الکترونی ندارد.
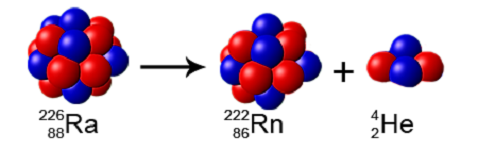 شکل (12): اتم رادون، از واپاشی اتم رادیوم به دست میآید.
شکل (12): اتم رادون، از واپاشی اتم رادیوم به دست میآید.
با در نظر گرفتن مدل اتمی بور و کوانتومی، یعنی در نظر گرفتن مدارهایی با انرژی متفاوت برای الکترونها، الکترونهای لایه آخر بستگی کمتری به هسته اتم داشته و به گرفتن انرژی کمی میتوانند از قید هسته رها شوند. در این صورت اتم به یون مثبت یا کاتیون (Cation) تبدیل میشود. در واقع با کاهش الکترونها، خنثی بودن اتم برهمخورده و به واسطه بیشتر بودن تعداد پروتونها (بار مثبت)، بار کل اتم، مثبت میشود.
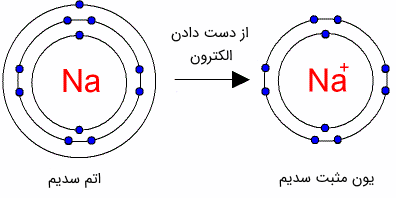 شکل (13): با کاهش تعداد الکترونها، اتم را یون مثبت میگویند.
شکل (13): با کاهش تعداد الکترونها، اتم را یون مثبت میگویند.
همچنین اگر اتم، بتواند در لایه ظرفیت خود، الکترونی را جای دهد، بار کل اتم منفی شده و تبدیل به یون منفی یا آنیون (Anion) میشود.
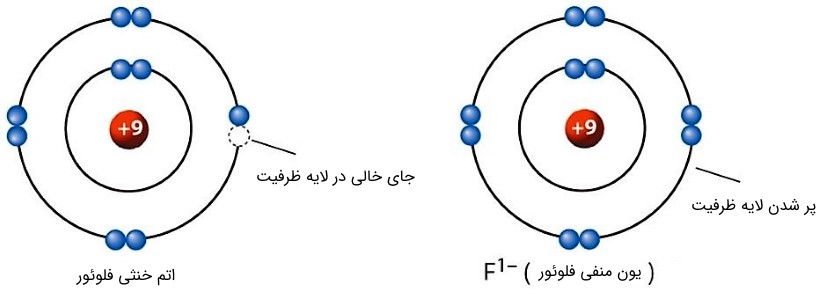 شکل (14): با افزایش تعداد الکترونها، اتم را یون منفی میگویند.
شکل (14): با افزایش تعداد الکترونها، اتم را یون منفی میگویند.
اهمیت و مزیت یونها، در بسیاری از کاربردها و واکنشهای شیمیایی نمایان است. به طور مثال اگر در باتریها، طی انجام واکنشهای شیمیایی یونهای مثبت تولید نمیشدند، ما نمیتوانستیم از الکترونهای آزاد شده به عنوان جریان الکتریکی استفاده کنیم. یا به عنوان مثال دیگر، میتوان به تولید نمک سدیم کلرید (NaCl) اشاره کرد. در اینجا یونهای مثبت سدیم، جذب یونهای منفی کلرید میشوند (بارهای مثبت و منفی یکدیگر را جذب میکنند) تا مولکولهای واحد سدیم کلرید را بسازند.
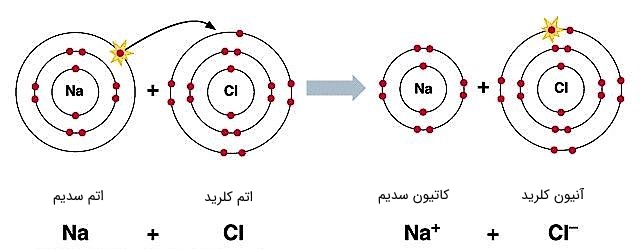 شکل (15): تشکیل مولکول NaCl از یونهای سدیم و کلرید، که به نام تجاری نمک معروف است.
شکل (15): تشکیل مولکول NaCl از یونهای سدیم و کلرید، که به نام تجاری نمک معروف است.
هنگامی که ترکیبات از طریق دو یا چند یون با یکدیگر پیوند تشکیل دهند، آن پیوند را، پیوند یونی (Ionic Bonding) مینامند. اکثر فلزات، ترکیبات خود را از طریق پیوند یونی تشکیل میدهند.
در شکل زیر میتوانید، اولین تصویر واقعی از اتمِ هیدروژن که در سال 2013 توسط میکروسکوپ کوانتومی قدرتمند گرفته شده است را مشاهده کنید:
 تصویر (16): تصویری میکروسکوپی از اتم هیدروژن
تصویر (16): تصویری میکروسکوپی از اتم هیدروژن
اتم چیست؟
به اطراف خود نگاه کنید. فرض کنید هرچیزی که در اطراف خود میبینید را به قطعات کوچکتری تقسیم کرده و این کار را بارها و بارها تکرار میکنیم. در نهایت متوجه میشویم که تمامی اجرامی که ما را احاطه کردهاند، از انواع مختلف اتم ساخته شدهاند. به عنوان مثال بیشتر چیزهایی که در زندگی خود میبینید از اتمهای اکسیژن، هیدروژن و کربن ساخته شدهاند. هوایی که تنفس میکنید غالباً از نیتروژن تشکیل شده است. فلزات پرکاربرد اطرافتان نیز غالباً از اتمهای آهن، مس، طلا و … ساخته شدهاند. شما همانند بازی LEGO، با کنار هم قرار دادن اتمها میتوانید تقریباً هرچیزی را که میخواهید بسازید.
تصویر (۱): نمایی از اتمهای استرانسیوم (Strontium) تحریک شده توسط پالس لیزری در یک ساختار مکعبی که توسط میکروسکوپ الکترونی در موسسه تحقیقاتی NIST تهیه شده است.
میتوان گفت که یک اتم، کمترین و کوچکترین مقدار یک عنصر شیمیایی است. به طور مثال، کمترین مقدار طلایی که میتوانید داشته باشید ۱ اتم است. ۱ اتم اندازه بسیار کوچکی دارد که حتی با میکروسکوپهای الکترونی قوی نیز دیدن آنها مشکل است. ابعاد یک اتم حتی از مرتبه نانو نیز کوچکتر بوده و در محدوده آنگستروم است. در مدل اتمی بور، شعاع یک اتم هیدروژن به مقدار 0.5 آنگستروم نتیجه شد. اتمهای سنگینترین عناصر نیز تنها کمی از این مقدار بیشتر هستند. لازم به ذکر است که هر ۱ آنگستروم (Angstrom) برابر با 10−1010−10 است.
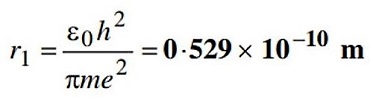
شعاع اتم هیدروژن که به شعاع بوهر معروف است. نیلز بوهر (Niels Bohr) در مدل اتمی خود که رویکردی شبه-کوانتومی داشت، به بررسی اتم هیدروژن پرداخت (1A=10−10m1A=10−10m).
شاید بگویید که اتم نیز قابل تقسیم است. بله این مطلب درست است، اما دقت شود که در اینجا کوچکترین مقدار یک عنصر همان اتم است. میدانیم که یک اتم از ذرات کوچکتری که به ذرات زیراتمی (الکترون، پروتون و نوترون) موسوم هستند، تشکیل شدهاند. اگر شما اتم را نیز به قطعات کوچکتری تقسیم کنید و یک پروتون از آن را جدا کنید (یا حتی بتوانید اضافه کنید)، اتم حاصل شده، دیگر اتمی از عنصر قبلی نیست. بلکه تبدیل به اتم دیگری میشود. جهت آشنایی بیشتر با عنصر، به مقاله «عنصر چیست؟ — به زبان ساده» مراجعه فرمایید.
اتم از چه چیزهایی تشکیل شده است؟
از فیزیک پایه به یاد دارید که یک اتم از هسته (شامل پروتون و نوترون) و ابری الکترونی (البته در توصیف کلاسیکی) ساخته شده است. در اکثر کتابهای علمی، شماتیک فرضی که از یک اتم رسم شده است، شامل هستهای است که پروتون و نوترونها را در خود جای داده و الکترونها همانند ماهوارههایی که به دور زمین میچرخند، در مدار خود در حال گردش به دور هسته اتم هستند (شکل 2). پیشنهاد میکنیم جهت آشنایی کاملتر با هسته اتم، به مقاله «هسته اتم یا نوکلید (Nuclide) — به زبان ساده» مراجعه فرمایید.
از نقطه نظر مکانیک کوانتومی، تعیین دقیق مکان یک الکترون ممکن نیست. فرض کنید که الکترونها آنقدر سریع تغییر مکان میدهند که امکان مشاهده آنها در مکانی خاص وجود ندارد. البته در برخی مکانها در لایههای مختلف، احتمال حضور الکترونها بیشتر است. به همین دلیل برخی کتابها الکترونها را به صورت هاشورهایی نمایش میدهند. به این مکانها، که احتمال حضور الکترون در آنها نسبت به جاهای دیگر زیاد است، اوربیتال گفته میشود. اوربیتالها بسته به موقیعت الکترونها که با اعداد کوانتومی مشخص میشود، شکلهای متفاونی دارند.

در بخش قبل گفتیم که با جداکردن یک پروتون از هسته اتم، آن اتم تبدیل به اتمی دیگر با خواص متفاوت میشود. آنچه اتمها را از یکدیگر متمایز میکند، تعداد پروتون و نوترونهای هسته و الکترونهای یک اتم است. در واقع جنس الکترون، پروتون و نوترونهای یک اتم طلا با اتم آهن یا هر اتم دیگری یکسان است. تفاوتهای ایجاد شده در خصوصیات اتمهای مختلف تنها در تعداد این ذرات است.
اجازه دهید دوباره به فرضی که در مقدمه متن عنوان شد باز گردیم. با توجه به مطالب گفته شده، شما میتوانید با تغییر در تعداد ذرات زیر اتمی، یک اتم را به اتمِ دیگری تبدیل کنید. کار را میتوانیم از سادهترین و کوچکترین (در واقع ابتداییترین) اتم، یعنی اتمِ هیدروژن (Hydrogen Atom) شروع کنیم. اتمِ هیدروژن تنها ۱ پروتون و ۱ الکترون دارد (اتمِ هیدروژن نوترون ندارد). با اضافه کردن ۱ پروتون، ۱ الکترون و ۲ نوترون به اتمِ هیدروژن میتوانید اتمِ گازی هلیوم (Helium Atom) را بسازید. حال دوباره با اضافه کردن ۱ پروتون، ۱ الکترون و ۲ نوترون به اتمِ هلیوم، میتوانید اتمِ فلزی لیتیوم (Lithium Atom) را بسازید. این روند را میتوانید تا تکمیل جدول تناوبی عناصر ادامه دهید (شکل 4).

همانطور که مشاهده کردید، در یک اتمِ خنثی تعداد الکترونها و پروتونها برابر است. تعداد الکترونها در یک اتم میتواند تغییر کند، که در این صورت به اتم، یون میگویند. اگر تعداد الکترونها کمتر از حالت خنثی، یعنی کمتر از تعداد پروتونها باشد، اتم را یون مثبت و اگر تعداد الکترونها بیشتر از تعداد پروتونها باشد، اتم را یون منفی میگویند. باز هم یادآور میشویم که تغییر در تعداد ذرات هسته اتم، به منزله تغییر ماهیت اتم است.
تعداد نوترونهای یک اتم میتواند متفاوت با تعداد پروتونها باشد، اما در اغلب حالتها تعداد پروتونها و نوترونها متفاوت است. به تعداد پروتونهای هسته یک اتم، عدد اتمی میگویند. همچنین به مجموع تعداد پروتونها و نوترونها، عدد جرمی گفته میشود. از آنجایی که جرم یک پروتون یا یک نوترون تقریباً 2000 برابر جرم یک الکترون است، جرم یک اتم را با تقریب خوبی میتوان جرم هسته آن در نظر گرفت. به جدول زیر دقت کنید.
| نام ذره | جرم (کیلوگرم – kg) | بار الکتریکی (کولن – C) | جرم نسبی | بار نسبی |
| پروتون | 1.672×10−271.672×10−27 | 1.602×10−191.602×10−19 | 11 | +1+1 |
| نوترون | 1.672×10−271.672×10−27 | 00 | 11 | 00 |
| الکترون | 9.109×10−319.109×10−31 | 1.602×10−191.602×10−19 | 1200012000 | −1−1 |

لازم به ذکر است که پروتونها و نوترونها نیز خود از ذرات کوچکتری موسوم به کوارک تشکیل شدهاند. در شاخهای از فیزیک نظری، موسوم به فیزیک ذرات بنیادی به بررسی ذرات تشکیل دهنده هسته اتمها در ریزترین مقیاس میپردازند. لازم به ذکر است که الکترون خود ذرهای بنیادی است و از ذرات دیگر تشکیل نشده است.
اتمها چگونه مولکولها و ترکیبات را تشکیل میدهند؟
میتوان گفت که اتمها شبیه به انسانها هستند که گروه و شراکت را به تنها بودن ترجیح میدهند. بسیاری از اتمها با سایر اتمها پیوند برقرار میکنند. چرا که در این صورت پایدارتراند. بنابراین اتمها هیدروژن به خودیخود یا به صورت تک (تنها) وجود ندارند، بلکه با یکدیگر جفت میشوند تا مولکول هیدروژن را پدید آورند. یک مولکول کمترین مقدار یک ترکیب است که از دو یا تعداد بیشتری اتم ساخته شده است.
اکثر افراد در تعاریف مولکول و ترکیب دچار اشتباه میشوند. اگر دو عنصر شیمیایی مختلف به یکدیگر بپیوندند، اغلب میتوانند یک ماده جدید را تشکیل دهند. به طور مثال، پیوند بین دو اتم هیدروژن و یک اتم اکسیژن، مولکول واحد آب را درست میکنند. آب یک ترکیب است، چرا که از ترکیب دو عنصر شیمیایی متفاوت به دست آمده است. همچنین به دلیل اینکه از ترکیب چند اتم پدید آمده، به عنوان یک مولکول نیز شناخته میشود. در واقع، ترکیبات، عناصری هستند که به یکدیگر متصل شدهاند و ملکولها، اتمهایی هستند که به یکدیگر وصل شدهاند.

جهت تعریف عنصر نیز میتوانیم بگوییم که عنصر ماده خالصی است که نمیتوان آن را به دو یا چند ماده تفکیک کرد. در واقع خواص یک عنصر ثابت است و نمیتوان با تفکیک آن موادی با خواص متفاوت به دست آورد. در نتیجه، عنصر مادهای است که تمام واحدهای تشکیل دهنده آن، اتمهای یکسانی باشند که به مواد سادهتری تجزیه نشوند.
همه مولکولها، به اندازه مولکول آب ساده و کوچک نیستند. به طور مثال مولکولهای مادهای پلاستیکی، از صدها یا حتی هزاران اتم جداگانه که به صورت زنجیروار یا رشتهای طولانی، موسوم به پلیمر، به یکدیگر متصل هستند، ساخته شدهاند. به طور مثال، مولکولهای پلیاتیلن (Polyethylene) نمونه سادهای از این مورد هستند. این پلیمر، با تکرار واحدهای یکسانی موسوم به مونومر، ساخته شدهاند.

ایزوتوپ چیست؟
گاهی اوقات در طبیعت عناصری یافت میشوند که کمی متفاوت به انتظارات ما رفتار میکنند. به طور مثال عناصر کربنی معمولی که در زندگی روزمره در غالب کاربردهای متفاوتی از آنها استفاده میکنیم، به کربن ۱۲ موسوم است. اتمهای کربن ۱۲ دارای ۶ الکترون، ۶ پروتون و ۶ نوترون است. در واقع اتمهای کربن ۱۲، دارای عدد اتمی ۶ و عدد جرمی ۱۲ هستند. شکل دیگری از کربن در طبیعت یافت میشود که به کربن ۱۴ معروف است. این نوع اتم کربن دارای ۶ الکترون، ۶ پروتون و ۸ نوترون است. به دلیل بیشتر بودن تعداد نوترونها در هسته اتم، اتم ناپایدار یا به عبارتی رادیواکتیو است. اتمهای رادیواکتیو به طور طبیعی از هم پاشیده میشوند و در نتیجه با تغییر ذرات درون هسته به اتمهای دیگری تبدیل میشوند. به طور مثال اتمهای کربن ۱۴ پس از واپاشی به اتمهای نیتروژن تبدیل میشود. پس به طور ساده و خلاصه ایزوتوپها، اتمهای مختلف یک عنصر با تعداد نوترونهای متفاوت هستند.
در مقدمه گفتیم که با تغییر دادن هسته اتمها میتوانیم اتمهای جدید را درست کنیم. پیشتر گفتیم که برای تولید هلیوم نیاز داریم تا ۱ پروتون، ۱ الکترون و ۲ نوترون به اتم هیدروژن اضافه کنیم. از آنجایی که اتم هیدروژن فاقد نوترون بوده، با ترکیب هستههای آن نمیتوان به اتم هلیم رسید. به نظر شما چگونه دو نوترون مورد نیاز را فراهم کنیم؟
برای تولید هلیوم از هیدروژن، به سراغ ایزوتوپهای اتم هیدروژن که حاوی نوترونها هستند میرویم .هیدروژن، دارای ۲ ایزوتوپ دیگر به نامهای دوتریوم (21D12D) و تریتیوم (21T12T) است که ساختار آنها در شکل زیر آمده است. پایدارترین این ایزوتوپها پروتیون (11H11H) با عدد جرمی ۱ است که غالباً آن را به همان نام هیدروژن میشناسیم. ایزوتوپ دوتریوم نیز به مقدار کمی در آب یافت میشود که به آب سنگین موسوم هستند. تریتیوم نیز در آزمایشگاه ساخته شده و پایداری خیلی کمتری دارد.

با استفاده از ایزوتوپ هیدروژن در راکتورهای همجوشی هستهای، میتوان به اتم هلیوم رسید. در راکتورهای همجوشی هستهای پلاسمایی از ایزوتوپهای هیدروژن با انرژی بسیار زیاد موجودند که طی فرآیندهایی کنترل شده در محیط راکتور، به یکدیگر برخورد کرده و هستههای آنها به اصطلاح به یکدیگر مطابق فرآیند زیر جوش میخورند. نوترون پرانرژی اضافی آزاد شده نیز از آنجا که خطرآفرین است، کنترل شده و جذب محیط میشود.
21D+31T→42He(3.5MeV)+n0(14.1MeV)12D+13T→24He(3.5MeV)+n0(14.1MeV)

همچنین میتوان با همجوشی هستهای دو اتمِ دوتریوم (21D12D) و لیتویم (63Li36Li)، به دو اتمِ هلیوم رسید.
21D+63Li→2(42He)+22.4MeV12D+36Li→2(24He)+22.4MeV
از طریق فرآیندهای همجوشی هستهای میتوان به اتمهای دیگری نیز دست پیدا کرد، اما از آنجا که انرژی مورد نیاز برای اتمهای سنگینتر از هلیوم بسیار زیاد است، تا به امروز چنین کاری امکان انجام ندارد.
به عنوان مثالی دیگر از واپاشی اتمهای رادیواکتیو میتوان به اتم رادیوم (Ra) اشاره کرد که پس از واپاشی به ذره آلفا (24He2+42He2+) و اتم رادون (Rn) تبدیل میشود. اتم رادون از خانواده گازهای نجیب است که آن را غالباً از واپاشی اتم رادیوم به دست میآورند. ذره آلفا نیز اتم هلیوم دوبار مثبت یا یون هلیوم است که هیچ الکترونی ندارد.

اتمها چگونه به یونها تبدیل میشوند؟
همانطور که پیشتر اشاره کردیم، یک اتم در حالت عادی خنثی است. در اینجا منظورمان خنثی بودن از لحاظ الکتریکی است. از آنجایی که نوترونها ذراتی بدون بار هستند، پس نتیجه میگیریم که بار الکتریکی الکترونها و پروتونها یکسان بوده که یکدیکر را خنثی میکنند. از فیزیک پایه به یاد داریم که الکترون را بار منفی با مقدار −1.602×10−19−1.602×10−19 و پروتون را بار مثبت با مقدار +1.602×10−19+1.602×10−19 در نظر میگیریم.با در نظر گرفتن مدل اتمی بور و کوانتومی، یعنی در نظر گرفتن مدارهایی با انرژی متفاوت برای الکترونها، الکترونهای لایه آخر بستگی کمتری به هسته اتم داشته و به گرفتن انرژی کمی میتوانند از قید هسته رها شوند. در این صورت اتم به یون مثبت یا کاتیون (Cation) تبدیل میشود. در واقع با کاهش الکترونها، خنثی بودن اتم برهمخورده و به واسطه بیشتر بودن تعداد پروتونها (بار مثبت)، بار کل اتم، مثبت میشود.

همچنین اگر اتم، بتواند در لایه ظرفیت خود، الکترونی را جای دهد، بار کل اتم منفی شده و تبدیل به یون منفی یا آنیون (Anion) میشود.

اهمیت و مزیت یونها، در بسیاری از کاربردها و واکنشهای شیمیایی نمایان است. به طور مثال اگر در باتریها، طی انجام واکنشهای شیمیایی یونهای مثبت تولید نمیشدند، ما نمیتوانستیم از الکترونهای آزاد شده به عنوان جریان الکتریکی استفاده کنیم. یا به عنوان مثال دیگر، میتوان به تولید نمک سدیم کلرید (NaCl) اشاره کرد. در اینجا یونهای مثبت سدیم، جذب یونهای منفی کلرید میشوند (بارهای مثبت و منفی یکدیگر را جذب میکنند) تا مولکولهای واحد سدیم کلرید را بسازند.

هنگامی که ترکیبات از طریق دو یا چند یون با یکدیگر پیوند تشکیل دهند، آن پیوند را، پیوند یونی (Ionic Bonding) مینامند. اکثر فلزات، ترکیبات خود را از طریق پیوند یونی تشکیل میدهند.
تاریخچه اتم
در جدول زیر، خلاصهای از مهمترین وقایع مربوط به کشف و بررسی اتمها آورده شده است.| سال | رخداد |
| 450 سال پیش از میلاد مسیح | از فیلسوفان یونان باستان، لوسیپوس (Leucippus) و دموکریت (Democritus) اولین افرادی بودند که مطرح کردند، مواد از ذرات کوچکتری ساخته شده است. |
| سال 1661 میلادی | «رابرت بویل» (Robert Boyle) مطرح کرد که عناصر شیمیایی، سادهترین اشکال ماده هستند. |
| سال 1789 میلادی | «آنتوان لاوازیه» (Antoine Lavoisier) لیستی از عناصر شیمیایی را تهیه کرد که از طریق واکنش شیمیایی قابل تجزیه یا جدا شدن نبودند. |
| سال 1803 میلادی | «جان دالتون» (John Dalton) نظریه اتمی ماده را مطرح کرد. از نظر دالتون هر عنصر شیمیایی از اتمها تشکیل شده است. |
| سال 1869 میلادی | «دیمتری مندلیوف» (Dmitri Mendeleyev) به طرز خارقالعادهای (بدون هیج ابزار اندازهگیری جهت وزن عناصر) نمونه اولیه جدول تناوبی عناصر را سازماندهی کرد. |
| سال 1896 میلادی | «هنری بکرل» (Henri Becquerel) به طور تصادفی پدیده رادیواکتیویته را کشف کرد. |
| سال 1917 میلادی | «ارنست رادرفورد» (Ernest Rutherford) طی آزمایش معروف ورقههای طلا، اثبات کرد که اتمها از ذرات کوچکتری ساخته شدهاند. همچنین مطرح کرد که اتم دارای یک هسته سنگین با بار مثبت است که ناحیه اطراف آن تقریباً خالی است. |
| سال 1919 میلادی | «فرانسیس آستون» (Francis Aston) تعداد زیادی از ایزوتوپهای اتمی را با استفاده از طیفسنجی جرمی کشف کرد. |
| سال 1938 میلادی | «اُتو هان» (Otto Hahn) و «فریتز استرسمن» (Fritz Strassmann) به اولین شکافت هستهای دست پیدا کردند. |
| سال 1945 میلادی | اولین بمبهای شکافت هستهای توسط آمریکا در دو شهر ژاپن در خلال جنگ جهانی دوم استفاده شد. |
| دهه 1960 تا 1970 میلادی | فیزیکدانان ذرات بنیادی پیبردند که چگونه ذرات زیر اتمی و بنیادی در کنار یکدیگر به تشکیل اتم منجر میشوند. |
| سال 2013 میلادی | توسط میکروسکوپی کوانتومی، اولین تصویر از اتمِ هیدروژن منتشر شد. |

نام موضوع : ساختار اتم
دسته : شیمی
